トピックスTopics
-目次
1. 界面き裂のリスクを測る: Interface Fracture Mechanics(界面破壊力学)
生体骨とチタン合金など人工構造材料との結合は、水酸アパタイト溶射皮膜により維持されています。しかし、その皮膜が生体内環境でどう劣化し、人工股関節のゆるみや破壊をもたらすのか、力学的機構は不明でした。生体内環境を模擬した疑似体液中での繰返し負荷試験により、水酸アパタイト皮膜の界面はく離が促進される機構を明らかにしました(Y Otsuka, et. al. ,MSC C 67 (2016), Y Otsuka, et. al. ,JMBBM 64 (2016))。そして、臼蓋カップとステムを一体型で繰返し負荷試験できる装置を独自に構築し、この装置を用いた損傷評価試験により、水酸アパタイト溶射皮膜の剥離により、臼蓋カップのゆるみが発生する力学的機構が存在することを実証しました(Y Otsuka, et. al. ,Engineering Failure Analyses (2022))。さらに、手術時の設置角度の誤差や、体重などの負荷量などの力学的因子が、臼蓋カップのゆるみリスクをどのように高めるのか有限要素解析により体系的に評価しました(QM Nguyen, Y Otsuka et. al. JMBBM (2023))。これにより、従来言われている、脱臼を防止するためのsafe zoneを守っていても臼蓋カップのゆるみが発生するメカニズムを解明することができました。この成果を展開し、ゆるみをもたらす力学的因子・生物学的因子の相互作用の解明や、メタマテリアルを用いたゆるみを生じない界面デザイン技術の開発に取り組んでいます。

水酸アパタイト溶射皮膜の界面端からのはく離進展が破壊力学で評価可能
Y Otsuka, et. al. ,MSC C 67 (2016)
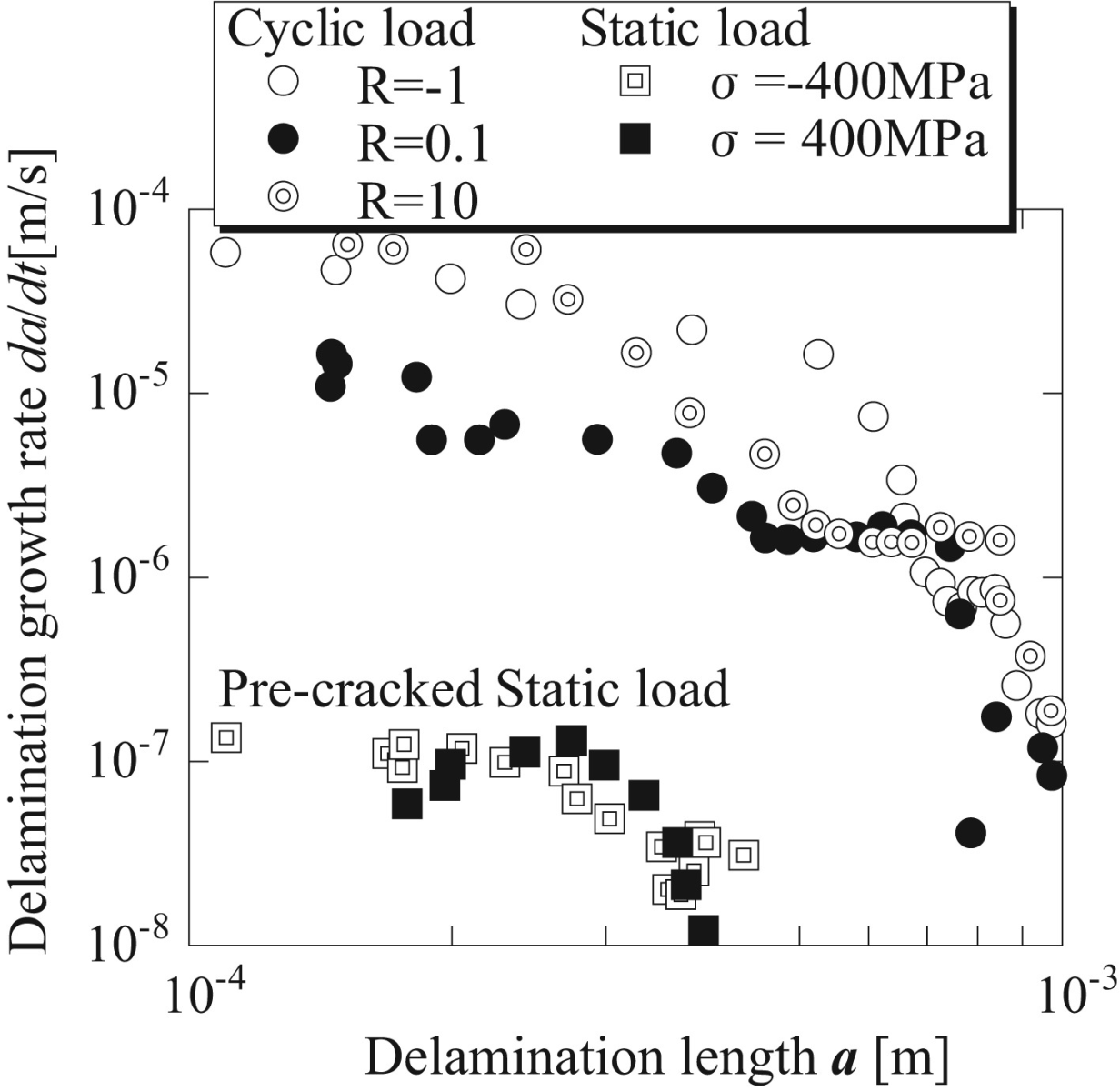
水酸アパタイト溶射皮膜の界面はく離は、繰返し負荷と摩耗により加速される
Y Otsuka, et. al. ,JMBBM 64 (2016)
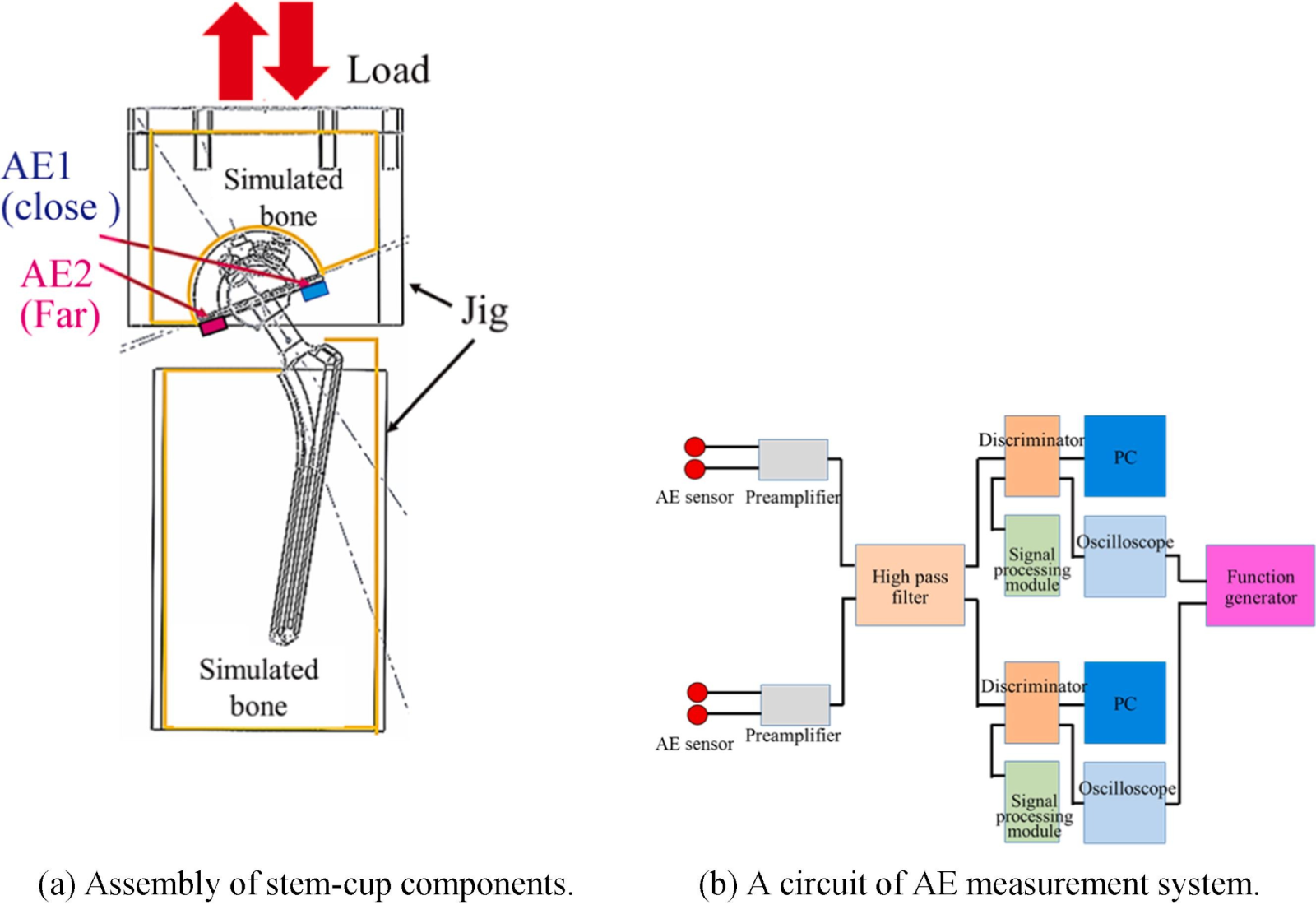
独自に開発した臼蓋カップの繰返し負荷試験装置により、水酸アパタイト皮膜のはく離がゆるみを促進することを実証
Y Otsuka, et. al. ,Engineering Failure Analyses (2022)
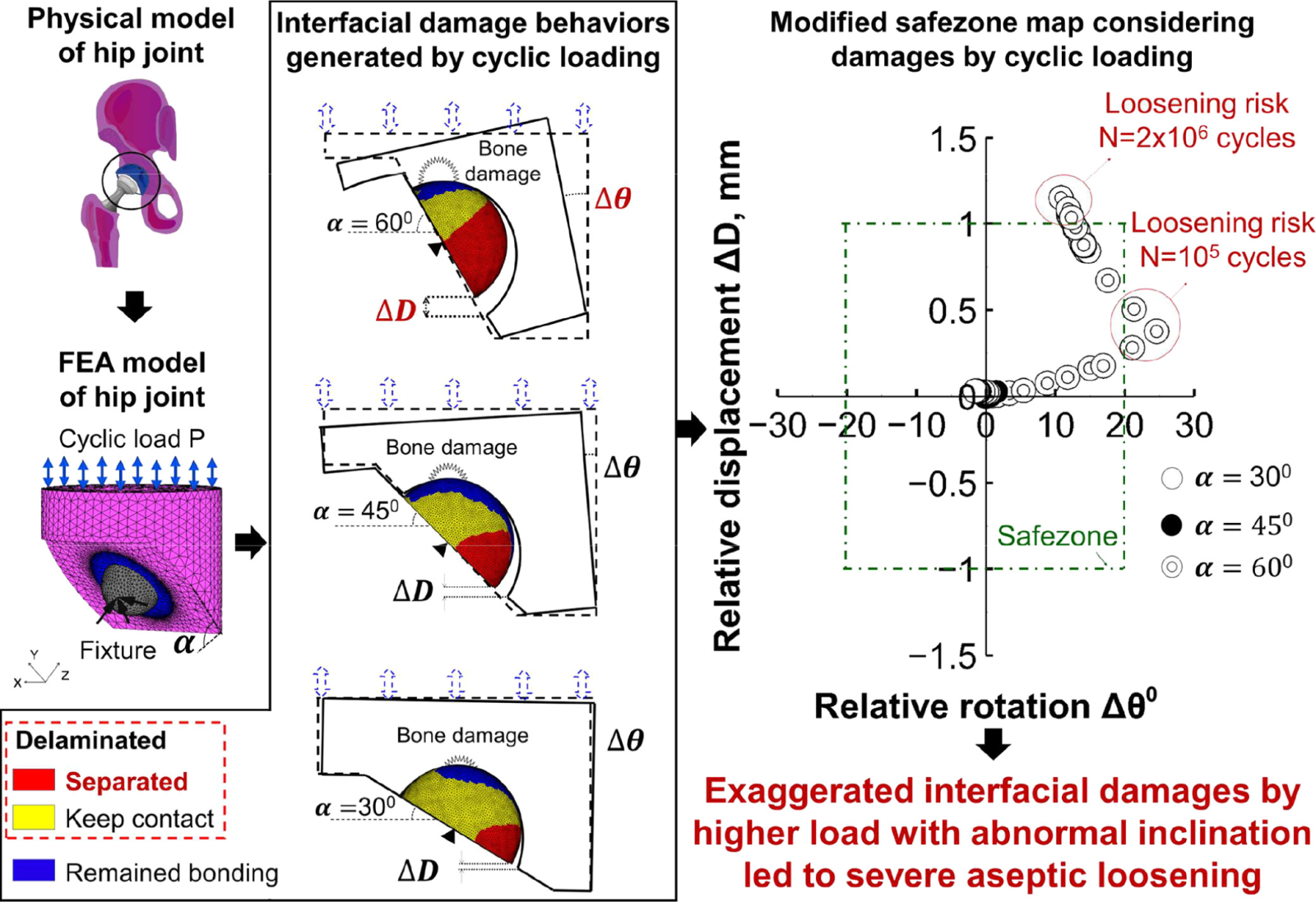
有限要素解析により、固定角度、負荷が界面はく離を進展させ、臼蓋カップのゆるみをもたらすことを評価することに成功
QM Nguyen, Y Otsuka et. al. JMBBM (2023)
2.界面損傷を見る:Integrated Damage Measurement (統合損傷計測)
生体材料などの表面は多孔質かつ粗さを持っており、き裂・はく離などの損傷を計測することは容易ではありません。本研究室では、光学測定・AE測定・赤外線測定を組み合わせた統合計測技術を構築しています。この技術の利点は以下のとおりです。- データ検証と妥当性確認
測定データのSN比を上げることができ、ノイズの中から損傷に対応するデータを相互に抽出できる。 - 計測のマルチスケール性
ミクロ損傷とマクロな変形特性の変化を同期して対応付けることができ、損傷メカニズムの議論が容易にできる。 - 相互作用の直接評価
温度変化や摩擦摩耗など、異なる損傷モード同士がどの様にに相互作用しているかを直接表現することができる。
これまで、純チタン多孔質体の表面に成膜した水酸アパタイト皮膜が、圧縮負荷試験中にはく離する様子を捉えることに成功しています。さらに、疑似体液中での繰返し負荷試験中にも、水酸アパタイト皮膜の繰返し負荷による早期はく離が起こる様子を捉えることに成功しました(M M Raihan, Y Otsuka et. al. JMBBM (2021))。そして、水酸アパタイト皮膜の界面はく離過程で、酸化チタンを添加した強化剤が界面強度を向上させる機構を解明することに成功し(MM Abir, Y Otsuka et.al., JMBBM 125 (2022))、さらに同じく臼蓋カップ上の水酸アパタイト皮膜のフレッティング摩耗損傷が、界面はく離をもたらすことで周囲温度が上昇することを捉えることに成功しています(Y Otsuka et. al. Procedia Structural Integrity 28 (2020))。金属3Dプリンタなどで作成した多孔質体・メタマテリアルの表面皮膜の生体適合性評価などに活用することを目指しています。
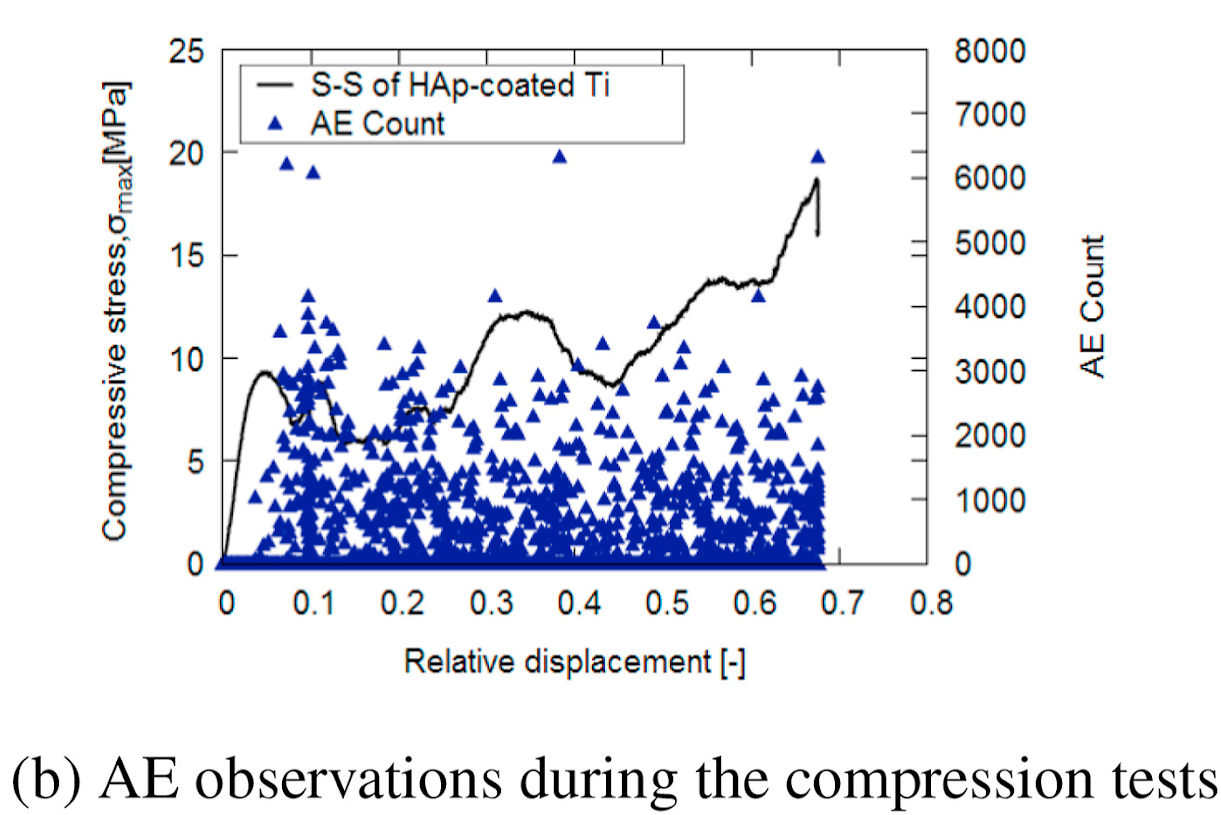
多孔質チタンの非弾性変形の発生限界が、AEにより多孔質体の幹の損傷により生じることを実証
M M Raihan, Y Otsuka et. al. JMBBM (2021)
M M Raihan, Y Otsuka et. al. JMBBM (2021)
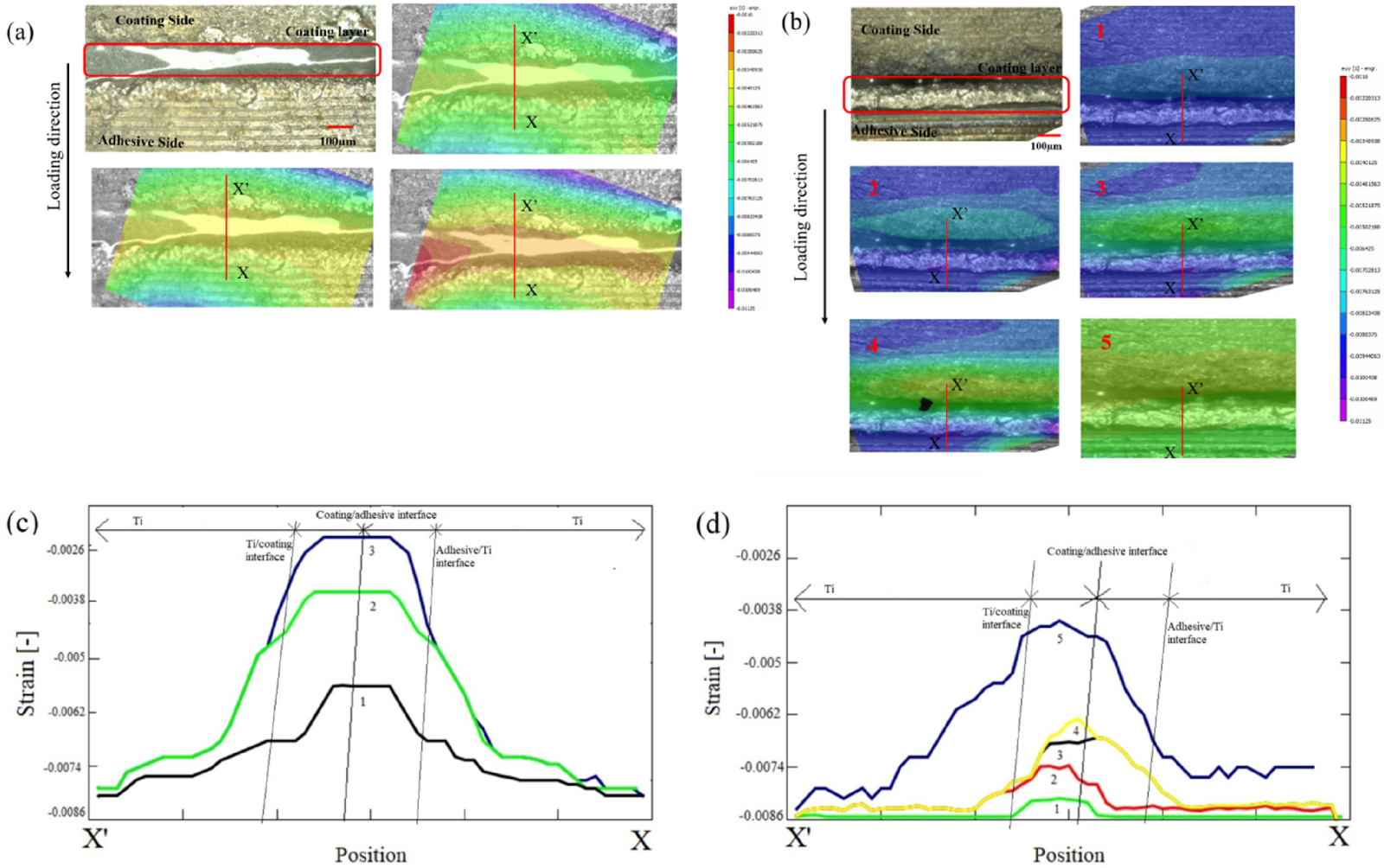
水酸アパタイト皮膜界面のはく離過程のひずみ測定により、端部でのひずみ集中抑制により界面強度が向上することを実証
MM Abir, Y Otsuka et.al., JMBBM 125 (2022)
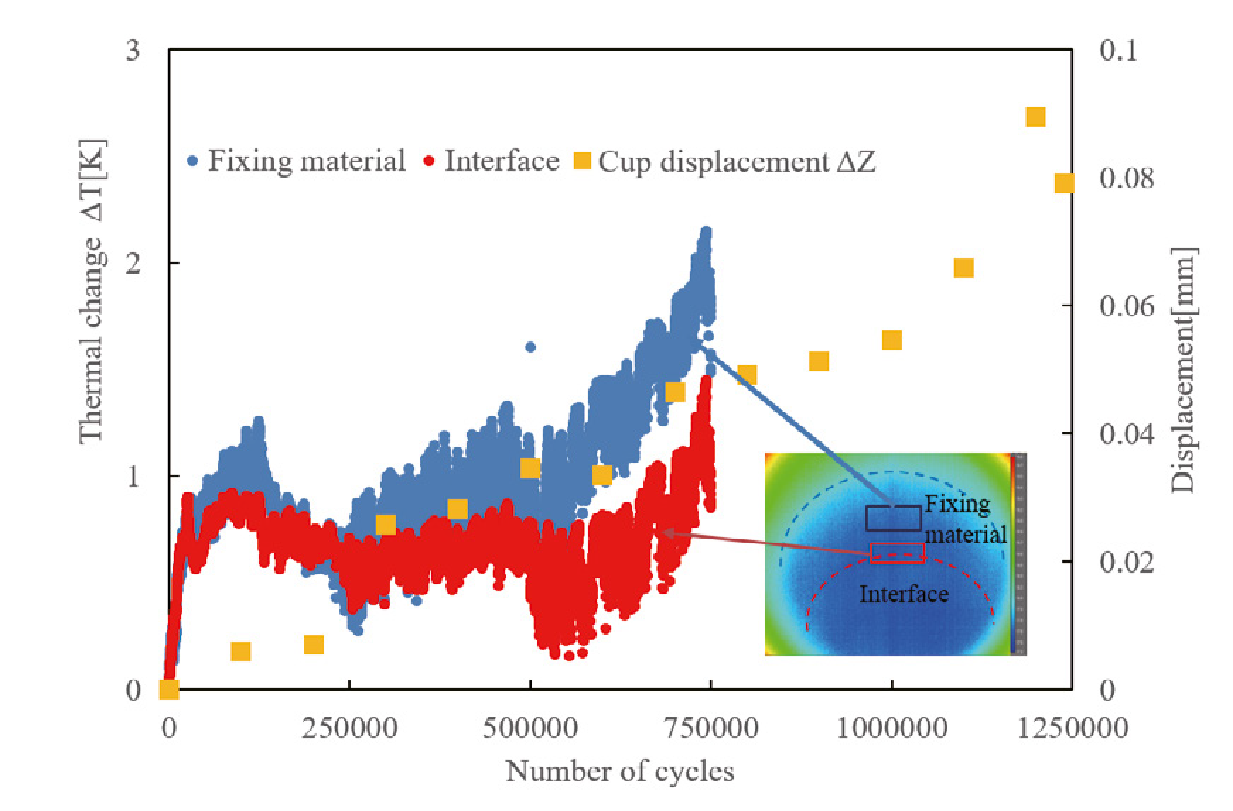
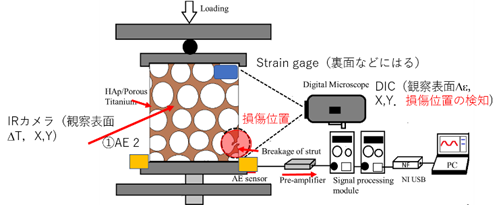
赤外線カメラとAEの統合計測により、はく離端部での摩耗損傷がはく離を促進させることを実証
Y Otsuka et. al. Procedia Structural Integrity 28 (2020)
3.長持ちする界面を創る:design of biocompatible interface(生体適合界面設計)
細胞や細菌と、人工構造材料の界面での結合が安定する機構を解明し、可視光照射や力学的負荷により、抗菌性や生体適合性を制御する技術を開発しています。これまでに、水酸アパタイトと有機分子の固相高圧合成法を構築し、錯体配位子の配向性が蛍光特性および可視光照射時の表面化学的特性の変化に寄与することを実証しています(T Matsuya,Y Otsuka, et. al. ,MSC C 58 (2016),S Morkul Y Otsuka, et. al. ,JMBBM (2018))。そして、通常では可視光吸収効率が低い酸化チタンに、プラズマ溶射を用いて酸素欠損を導入する技術を開発し、可視光照射時に抗菌性を発現するラジカルが生成することを実測しました(T Matsuya,Y Otsuka,, et. al. ,Applied Surface Science 64 (2016).)そして、可視光照射により抗菌性を発現する皮膜の開発に成功しています(MM Abir, Y Otsuka et.al., JMBBM 125 (2022))。これらの技術は、歯科医師との共同開発による実用化検討も進んでいますK Leelanarathiwat, K Minato, Y Katsuta, Y Otsuka, et al.,Dental Materials Journal 38 2019, K Minato, Y Katsuta, Y Otsuka, et al,Odontology 2021 など)。そして、表面の複雑形状による細胞接着性の変化とその力学的評価や、摩擦界面における細胞毒性の直接評価など、界面での力学的負荷による損傷と生体適合性の関連性についての実証研究を展開しています。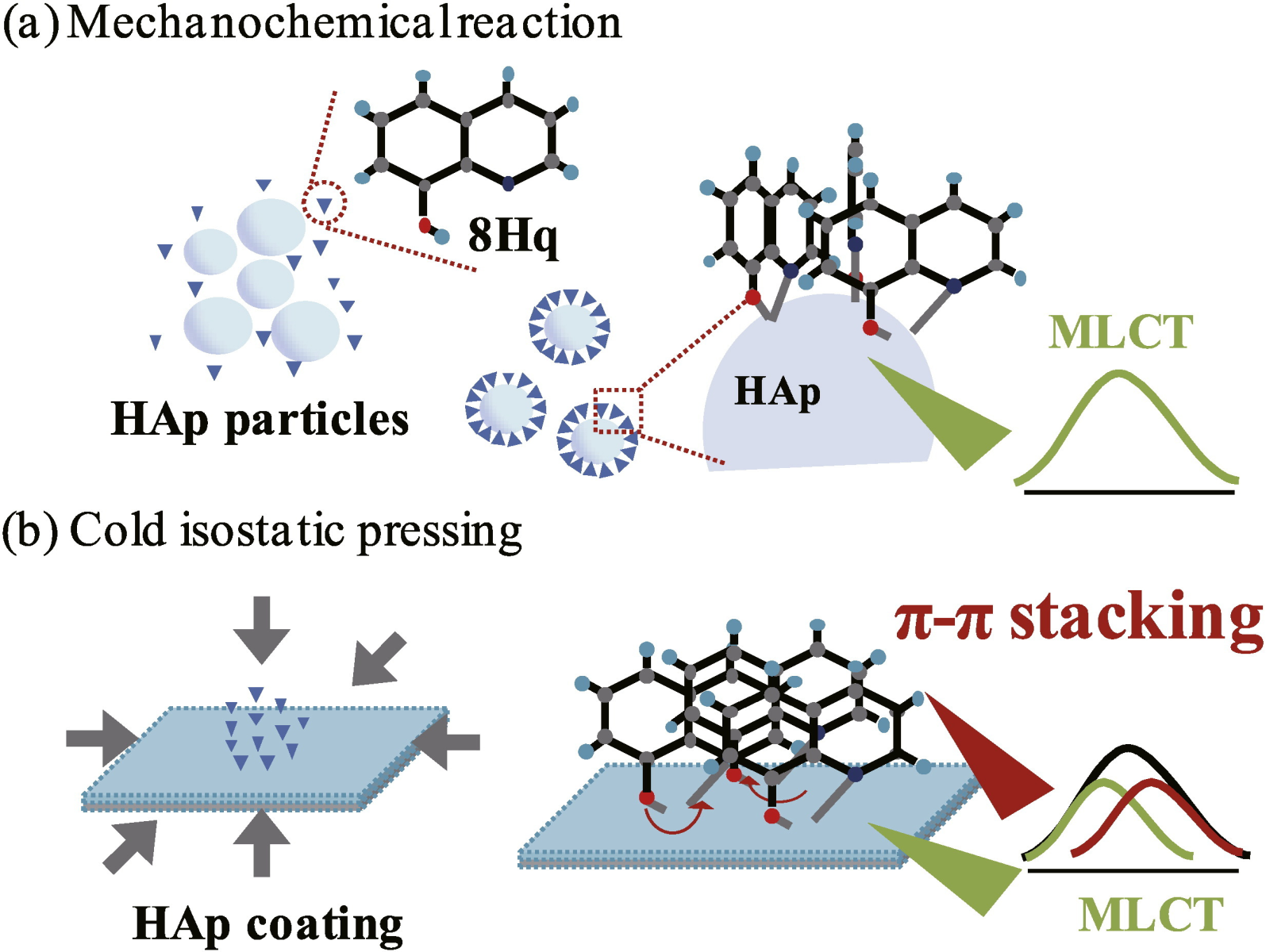
高圧メカノケミカル合成により錯体配位子が配向し、蛍光特性を変調できる水酸アパタイト蛍光錯体の合成に成功
T Matsuya,Y Otsuka, et. al. ,MSC C 58 (2016)
.png)
プラズマ溶射で作成した酸素欠損型酸化チタンは可視光照射により抗菌性を発揮するラジカルを発生させることを実測
T Matsuya,Y Otsuka,, et. al. ,Applied Surface Science 64 (2016)

抗菌性と生体適合性を両立させた水酸アパタイト・アミノ酸錯体の高圧合成に成功
S Morkul Y Otsuka, et. al. ,JMBBM (2018)

水酸アパタイト・酸化チタン複合皮膜が可視光照射で抗菌性を発揮する
MM Abir, Y Otsuka et.al., JMBBM 125 (2022)
この他にも、摩耗の学理に迫るナノスケール研究や、分子動力学解析、溶射技術の開発など、派生した多様なトピックがあります。興味のある方は、ぜひお問い合わせください。